Investigación
Una empresa del Parque Científico de la Universidad de Alicante prevé comercializar un medicamento para tumores cerebrales en 2024
El estudio clínico en pacientes con glioblastoma, una patología muy agresiva, se encuentra en fase de finalización
El próximo año se pondrá en marcha la planta de producción del principio activo del LAM561, un derivado sintético del ácido oleico

Laboratorios de la empresa biotecnólógica que investiga soluciones a tumores cerebrales. / INFORMACIÓN
J. Hernández
La empresa del Parque Científico de la Universidad de Alicante Laminar Pharma está desarrollando el compuesto LAM561 para el tratamiento de glioblastoma, un tumor cerebral muy agresivo, que se encuentra actualmente en fase 3 y que ya ha superado los 75 pacientes reclutados para su estudio clínico. Esto supone más del 50% del total necesario para el análisis final situado en 140.
Las cifras de la tasa de reclutamiento que está registrando Laminar Pharma se han cuadriplicado en comparación con los años anteriores post-pandemia. Se trata de una empresa biotecnológica en fase clínica centrada en el desarrollo de nuevas terapias para tratar diversas patologías con altas necesidades médicas.
El estudio clínico del LAM561 para el tratamiento del glioblastoma se está llevando a cabo en 18 centros hospitalarios distribuidos por España, Italia, Reino Unido y Francia. Concretamente en España, las comunidades autónomas que cuentan con hospitales que están desarrollando el estudio clínico son Madrid, Cataluña, Comunidad Valenciana y Andalucía, que suman un total de 9 centros. Para acelerar el ensayo clínico y permitir la participación de más pacientes, Laminar tiene previsto abrir el ensayo a nuevos hospitales de los países participantes, añadiendo hasta 5 centros en Alemania.
Si todo continúa según lo previsto, la compañía nacida en el Parc Científic de les Illes Balears y también con sede en el Parque Científico de Alicante, solicitará la autorización condicional de comercialización en Europa en 2024.
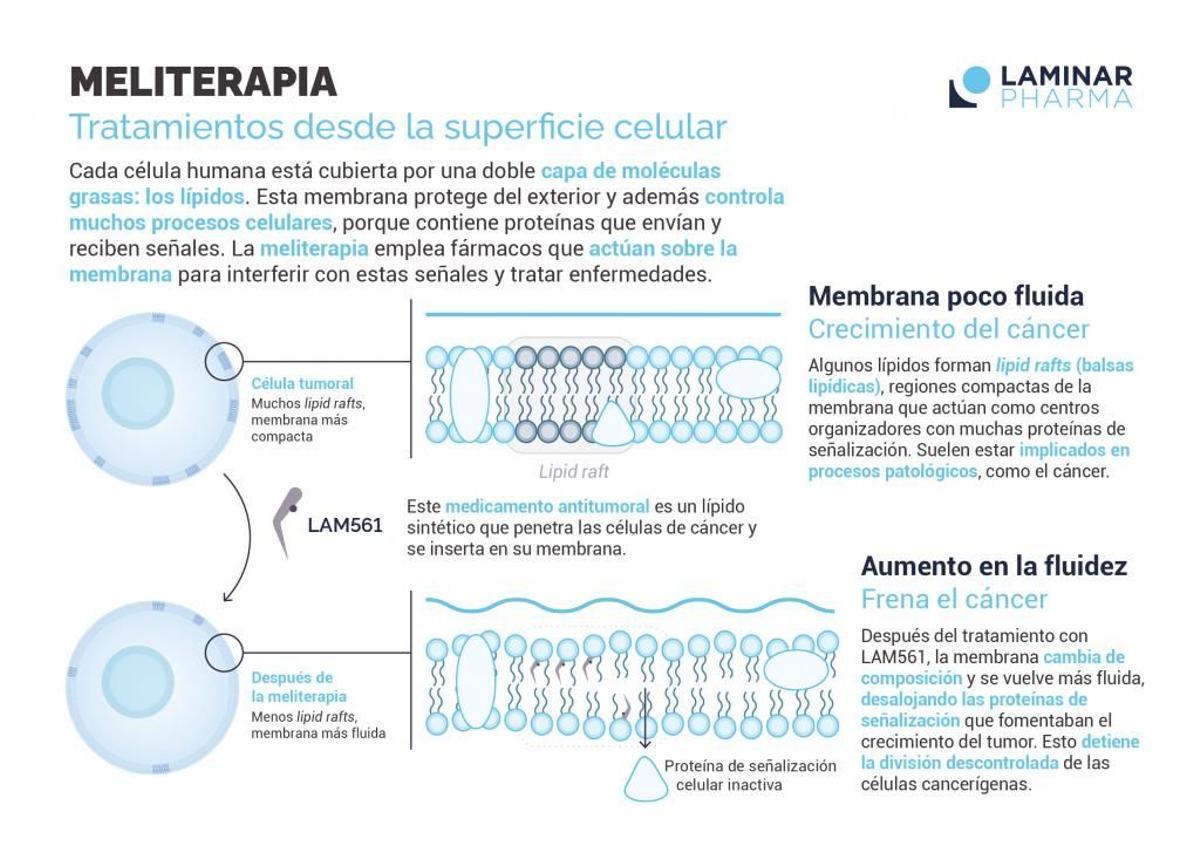
Gráfico sobre el medicamento.
Será a finales del próximo año cuando esté en funcionamiento la planta de producción del principio activo del LAM561 en el Parque Científico de la UA, tal y como ha señalado el director financiero de la empresa, David Roberto, y lo hará bajo el paraguas de otra empresa del parque, Medalchemy, donde en estos momentos se está produciendo este principio.
El LAM561 se ingiere por vía oral y, aunque inicialmente está dirigido al tratamiento del glioblastoma, ha mostrado en resultados preliminares positivos que tiene potencial para expandir su uso a otras indicaciones oncológicas en el futuro. En cuanto a su composición, es un derivado sintético del ácido oleico que, entre otras cosas, pretende paliar los efectos secundarios tan severos de la quimioterapia y que es capaz de llegar a las células del cerebro cruzando la barrera hematoencefálica.
En el aspecto financiero, Laminar Pharma se encuentra en estos momentos con una ronda de financiación abierta en la que ya se han superado los 6 millones de euros, una cifra que la convierte en la mayor ronda de la historia de la compañía, pese a que todavía quedan varios días para el cierre de la misma.
"Es increíble el trabajo que está haciendo el equipo de LamInar Pharma. Estamos muy orgullosos de todo el equipo que conforma la empresa y les vamos a seguir apoyando en todo lo que podamos"
El director del Parque Científico de Alicante, Esteban Pelayo, se muestra muy confiado en el futuro lanzamiento del LAM561 y que este producto salvará muchas vidas. "Es increíble el trabajo que está haciendo el equipo de Laminar Pharma. Desde el PCA estamos muy orgullosos de todo el equipo que conforma la empresa y les vamos a seguir apoyando en todo lo que podamos", manifiesta Pelayo.

Otra imagen del personal investigador.
LAM561 ya ha recibido la designación de medicamento huérfano para el tratamiento del glioma por parte de la Agencia Europea del Medicamento y la FDA (Food and Drugs Administration en EE.UU) y la designación de “Fast-Track” por parte de la esta última en agosto de 2022 para el tratamiento del glioblastoma.
La designación de “Fast-Track” facilita el desarrollo y acelera el proceso de revisión de medicamentos diseñados para tratar afecciones graves con necesidades médicas no cubiertas. Este estatus también permite un diálogo continuo con la agencia norteamericana en relación con el desarrollo clínico y regulatorio del LAM561, explican desde Laminar.
Pablo Escribá, consejero delegado, expresa su agradecimiento a los miembros del equipo, "a todos nuestros colaboradores y a los profesionales de los hospitales participantes en el estudio clínico por su dedicación y diligencia en el apoyo al ensayo. También a los pacientes que participan voluntariamente en el ensayo. Participar en un ensayo clínico requiere un tiempo y esfuerzo considerables por parte de los pacientes y sus familias, especialmente de aquellos que han recibido el tratamiento en investigación durante varios años".
- Se vende la última 'joya' inmobiliaria en Andratx: una mansión de 22,5 millones con un embarcadero privado para un yate de hasta 130 metros
- Guillem Ferrer, activista y participante en el acto de Miguel Bosé y Josep Pàmies: 'El conocimiento científico no es prioritario, sino complementario
- Denuncian a una pasajera por discutir por el calor con una azafata en un vuelo hacia Palma
- El mallorquín detenido tras el concierto de Karol G en Madrid: “Sí, he sido yo; le he golpeado pero se ha hecho daño al caer”
- Salud expedienta a los organizadores del evento de Miguel Bosé 'por difundir información falsa sobre la salud
- Los bares de Sineu deberán permitir el acceso libre a los baños el día del Much
- Detenido un hombre por quemar su casa con su mujer y su hijo dentro en Palma
- Graban en vídeo la impericia y la temeridad de unos turistas en barco alquilado para salir de Cala Estreta, en Artà